Kanser tedavisinde mTOR sinyal yol ağı ve mTOR inhibitörleri
mTOR (Rapamisin protein kompleksinin memeli hedefi) hücre büyümesi ve metabolizmasında önemli role sahiptir.
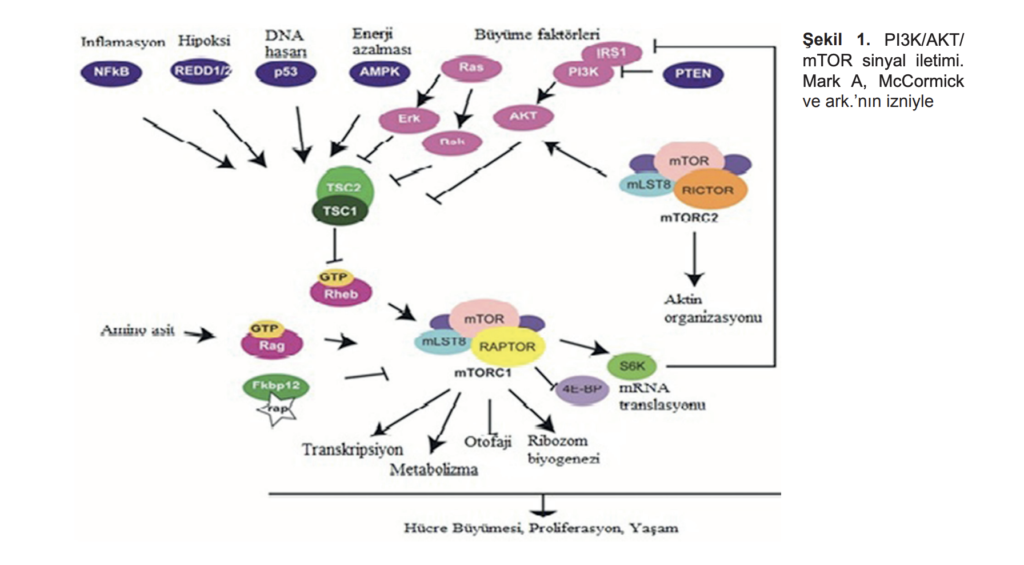
25ÖZET: Kanserde önemli olduğu saptanan üç temel sinyalizasyon yolu; (PI3K)/AKT kinaz zinciri, protein kinaz C ailes (PKC) ve mitojenle aktive olan protein kinaz (MAPK)/Ras vardır. mTOR; PI3K/AKT sinyal yolağının akış aşağı aktivasyonunda anahtar bir kinazdır. Bu yolaklar sıklıkla kanserde bozulur ve bu yüzden de mTOR önemli bir antitümör hedeftir.
mTOR katabolik ve anabolik metabolizmalar arasında anahtar işlevi olan bir kinazdır. Rapamisin (sirolimus), 1975 yılında Rapa Nui’de toprak mahsullerinden doğal olarak üretilmiştir.
Başlangıçta immün supressif özelliklere sahip antifungal bir ajan olarak kullanılmıştır. Bunun memeli analoğu ise mTOR olarak tasarlanmıştır.
Rapamisin 1980’li yıllarda Amerika Ulusal Kanser Enstitüsü tarafından antikanser aktivitesi yönünden analiz edilmiş ve geniş antikanser aktiviteye sahip olduğu tespit edilmiştir.
Sonraları 1990’larda rapamisinin substratı TOR olarak tanımlanmıştır. Antikanser ajanlar olarak mTOR inhibitörlerinin ortaya çıkışı ana molekülden ziyade rapamisin analogları ile başlamıştır. Güncel olarak bu analoglar temsirolimus, everolimus, ridaforolimus ve deforolimustan oluşmaktadır.
mTOR inhibitörlerinin kanserli hastalarda güvenilirlikleri ve etkinlikleri kanıtlanmıştır. mTOR inhibitörleri ile yapılan klinik çalışmalar uzun süreli objektif tümör yanıtı sağlamıştır. Bu nedenle de temsirolimus ve everolimusa FDA ve EMEA tarafından renal hücreli kanser tedavisinde endikasyon verilmiştir.
mTOR inhibitörü ilaçların meme, lenfoma, akciğer, mide ve sarkom kanserlerini içine alan çeşitli solid tümörlerde etkinliği gösterilmiştir.
mTOR SİNYAL YOLAĞI VE MEKANİZMASI
Kanser hücrelerinde sinyal iletimi sıklıkla sitoplazmik kinazları (serin/tirozin kinazlar gibi) tetikleyen reseptör tirozin kinazların (RTK) aktivasyonunu içerir. mTOR, hücre içi sinyal kaskatlarında merkezi bir noktaya yerleşmiş olan hücre içi bir serin/treonin protein kinazdır. Kanserde önemli olduğu saptanan üç büyük sinyalizasyon yolu arasında (PI3K)/ AKT kinaz zinciri, protein kinaz C ailesi (PKC) ve mitojenle aktive olan protein kinaz (MAPK)/Ras sinyalizasyon zincirleri yer almaktadır.
Önemli bir sinyal yolu olan PI3K/AKT/mTOR proteinin işlev süreci, reseptör tirozin kinazlar ile yakın ilişkilidir (Şekil 1). Damar endoteli büyüme faktörü (VEGF) reseptörünün (VEGFR), trombosit kaynaklı büyüme faktörü (PDGF) reseptör-a, epidermal büyüme faktörü (EGFR), c-Met gibi çeşitli RTK’lar kanser hücrelerinden salınabilir.
Bu RTK’lar için kanser hücrelerinin fonksiyonunu biçimlendirmede RTK’ların aktivasyonu bu reseptörlerin sitoplazmik tirozin rezidülerinin otofosforilasyonuna neden olur.
Bu da PI3K’nın düzenleyici alt birimi P85 proteinini etkinleştirir. P85, insülin reseptör substratları (IRS-1, 2) tarafından indirekt olarakta aktive edilebilirler.
Sonrasında, PI3K katalitik alt birimi P110 proteini fosfatidilinositol-4,5-bifosfat(PIP2)’ı fosfatidilinositol-fosfata (PIP3) dönüştürür.
Ayrıca RTK’lar tarafından RAS aktivasyonuda PI3K dolaylı bir aktivasyona yol açabilir.
PI3K, fosfataz ve tensin homoloğu (PTEN) tarafından PIP3 defosforile edilerek negatif yönde kontrol edilmektedir. AKT, serin / treonin kinaz fosfatidilinositol 3-bağımlı kinaz 1 (PDK1) tarafından fosforillenerek aktive olur.
AKT’ın aşağı sinyal yolağı effektörlerinden (downstream effectors) en önemlisi mTOR’dur. AKT, mTOR’u tuberöz skleroz-2 (TSC2) doğrudan fosforilasyonu ile veya AMPK’nın inhibisyonu ile aktive eder. mTOR ayrıca tirozin kinaz reseptörlerinin aktivasyonu ve bunu izleyen PI3K)/AKT fosforilasyonu, büyüme faktörleri ile aktive edilebilir. Aşağı doğru sinyal yolaklarında aktive olmuş AKT, TSC1 ve TSC2 tüberöz skleroz kompleksini içeren bir protein dimerinin büyüme baskılayıcı etkilerini engeller.
TSC1/TSC2 kompleksinin baskılayıcı etkilerinin engellenmesi RAS homoloğu Rheb’in mTOR’u aktive etmesine neden olur. Bu da mTOR’un aşağı doğru sinyal yolağında temel hedefi olan P70SK6 ve 4EBP1 üzerine etkisine olanak tanır. AKT ise PTEN ve TSC1/TSC2 heterodimeri gibi iki tümör supressör ile kontrol edilir.
TSC1/ TSC2 heterodimerleri Rheb’ in aktivitesini GTP fosfataz aktivasyonuyla inhibe ederek mTOR aktivitesini inhibe eder.
AKT, PRAS40 proteozomal yıkımını sağlar. Fosforillenmemiş PRAS40 raptoru bağlar ve mTORC1 kompleksinden ayırır. Son çalışmalarda PRAS40’ın mTORC1 aktivasyonunda önemli olduğunu göstermiştir.14 Fosforillenmiş mTORC1, aşağı sinyal iletim effektörleri; 4EBP1 ve P70S6 kinaz (S6K) aracılığıyla hücre büyümesini, hücre siklusu progresyonunu ve hücre metabolizması için gerekli proteinlerin mRNA ribozomal translasyonunu sağlar.
Hücre çoğalmasının durduğu fazda fosforillenmemiş 4EBP1, eIF4E’ye sıkıca bağlıdır ve protein translasyonun başlamasını inhibe etmiş olur. Büyüme faktörleri gibi uyarıcılar mTOR yolu üzerinden 4EBP1’i fosforiller. Bu da 4EBP1’i eIF4E’nin ayrılmasına neden olur. eIF4E, c-myc, cyclin D1ve ornitin dekarboksilaz gibi proteinlerin translasyonu ile G1’den S faza hücre siklusunun ilerlemesini sağlar. Böylelikle de hücre siklusunun ilerlemesinde yer alan proteinlerin (cyclin D1, c-myc gibi) mRNA translasyonlarını düzenler. Sonuç olarak mTOR inhibitörleri, hücre döngüsü için gerekli proteinlerin translasyonunu ve hücre döngüsünün G1 fazından S faza geçişini engeller.
Ayrıca 4EBP1’nin fosforilasyonu HIF-1a sentezinde artmaya neden olur. 4EBP1’nin dışında S6K1’ının fosforilasyonu da mRNA translasyonunu sağlamaktadır. Ayrıca S6K1, IRS-1 inhibisyonu yoluyla PI3K/AKT/mTOR’ u negatif geribildirim ile inhibe etmektedir. Son çalışmalarda mTORC2 kompleksinin fosfoinositid bağımlı kinaz 2 (PDK2) ve AKT’ın fosforillenmesi gibi fonksiyonları gösterilmiştir.16 Bu yolaklar hücre profilerasyonunda ve tümörogenezde önemlidir. Bunlardaki bozukluklar birçok kanserin patogenezinde yer almaktadır(Tablo I).
Kanser hücrelerinde pek çok farklı mekanizma PI3K/AKT/ mTOR yolunun yapısal aktivasyonu ile sonuçlanabilir. mTOR aktivasyonu ile sonuçlanan hücre içi süreçleri PTEN fonksiyonu kaybı, PI3K p110 katalitik ünitesinin mutasyonu veya amplifikasyonu, PI3K p85 düzenleyici ünitesinin mutasyonu, AKT1 ve 2 AKT enzimlerinin her hangi birisinin amplifiaksyonu ve tuberöz skleroz 1 (TSC1) veya TSC2 gibi AKT ile ilişkili mTOR düzenleyici proteinlerin inaktivasyonu ya da mutasyonlarını içerir.1 İlginç olarak, mTOR’un kendisinin herhangi bir mutasyonu bildirilmemiştir.
mTOR yolu, insan epidermal büyüme faktörü reseptörleri 1-4 (HER1-4), trombositten türeyen büyüme faktörü reseptörü (PDGFR)/KIT ve insülin büyüme faktörü reseptörü (IGFR) gibi aşırı eksprese edilmiş veya mutasyona uğramış tirozin kinaz reseptörleri dahil eksojen onkogenler ile aktive edilebilir ve Ras doğrudan PI3K p110 alt ünitesine bağlanır. mTOR sinyal iletiminde, S6K1 veya eIF4E aşırı ekspresyonu ve/veya amplifikasyonu da onkogeneze katkıda bulunabilir.
Ancak, kanserde mTOR aktivasyonu için bir gerekçe daha vardır. Aktifleşen p53 mTOR negatif düzenleyicisi olarak etkide bulunur. Örneğin, glukozdan yoksun kalınan koşullarda, kanserde p53 fonksiyonu sıklıkla ortadan kalkar ve böylece bu durum mTOR yapısal aktivasyonunun lehine olabilir.17,18 mTOR; fosfatidilinozitol 3-kinaz (PI3K) aktivasyonunun sinyal iletiminde etkili temel bir kinazdır.
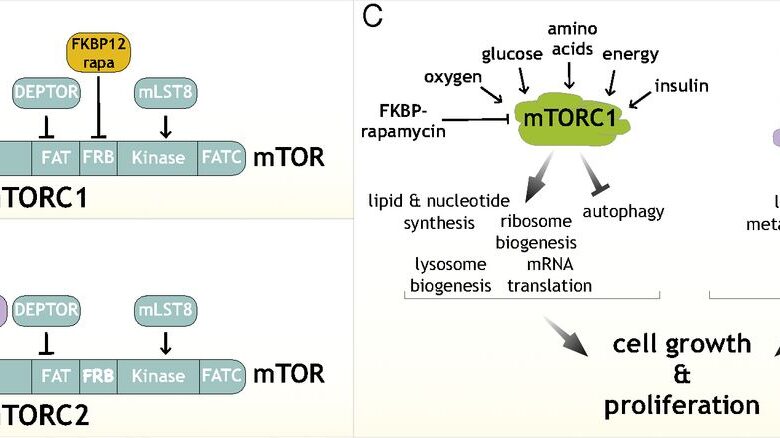
mTOR; PI3K/AKT sinyal transdüksiyon yolağının bir bileşenidir (Şekil- I,II).1,11 mTOR inhibitörü ilaçlar, hücre içi protein olan FK506 bağlayıcı protein-12 (FKBP-12) ile kompleks oluşturarak raptor’un mTOR’a bağlanmasını engelleyerek mTOR aktivitesini önlerler.
mTOR proteini sitoplazmada bulunan mTOR kompleks 1(mTORC1) ve mTORC2 bileşenlerinden oluşur. mTOR inhibitörleri sadece mTORC1’i etkileyip, mTORC2’yi etkilememektedir. Bu ilaçlar, mTOR’un seçici inhibitörü olup mTORC1’i inhibe ederler.
mTOR, ilişkili protein komplekslerine bağlı olarak iki tarzda fonksiyon göstermektedir. Örneğin mTORC1 mTOR’un ilişkili düzenleyici proteinlerinden ve diğer çeşitli proteinlerden oluşmaktadır. mTORC1, sirolimusa ve besin seviyelerine duyarlıdır. Aksine mTORC2, sirolimusa duyarsızdır. mTORC2’den ziyade mTORC1, sirolimus ve sirolimus analogları tarafından mTORC1’in yukarı ve aşağı doğru sinyal akımı etkilerine dayanarak antitümör bir hedef olarak görülmüştür.
Bu nedenlerle mTOR denildiğinde mTORC1’den bahsedildiği anlaşılmalıdır.
Spesifik olarak mTORC1, spesifik mRNA translasyonu gibi protein sentezini düzenleyen süreçleri kontrol ederek hücresel büyümeyi yönetir ve ribozomal proteinler ile G1’in S-fazı hücre döngüsüne dönüşümünü ve anjiyogenezi düzenler. PI3K/AKT yolağı üzerinden akış yukarı olarak mTORC1, büyüme faktörleri, hormonlar, hücre içi enerji düzeyleri ve hipoksi gibi çeşitli sinyaller tarafından düzenlenmektedir.1,2 mTORC1 sinyal yolağının karmaşık ağı aşağıda gösterildiği gibidir(Şekil 1).
mTOR’un önemli fonksiyonlarından biri hücre siklusunun ilerlemesinde yer alan proteinlerin (siklin D1, c-myc) mRNA translasyonlarını düzenlemesidir. Ayrıca hipoksik durumlarda tümörün büyümesini sağlayan angiogenez yolaklarında yer alan hipoksi ile indüklenmiş faktörlerin (HIF) mRNA translasyonuna da yardımcı olur. mTOR kinaz aktivitesinin bir substratı 4EBP-1’dir ve mRNA translasyonunu başlatma faktörü 4E (eIF4E) aktivitesini düzenler.
4EBP-1proteini pasif hücrelerde eIF4E aktivitesini baskılar böylece mRNA translasyonun başlamasını engeller. Ancak 4EBP-1proteinin hiperfosforilasyonu, 4EBP-1’in eIF4E’ye olan ilgisini azaltır. Böylelikle baskılayıcı proteinin ayrılmasına ve bunun devamı olan siklin D1, c-myc ve ornitin dekarboksilaz gibi G1 fazın ilerlemesinde görevli olan proteinlern mRNA translasyonun başlamasına neden olur.15 Ayrıca, mTOR’un apoptotik hücre ölümünün düzenlenmesinde etkilidir.
Apoptotik ölümde temelde p53, B-hücreli lenfoma 2 (BCL2), BCL2-antagonisti (BAD), p21, p27 ve c-myc gibi sinyal iletim hedefleri belirleyicidir.
m TOR aktivasyonu hücre ölümünü düzenleyen bu molekülleri inhibe eder.1 Yine başka çalışmalarda mTOR’un tümör hücre motilitesinde, anjiyogenezinde ve kanser metastazlarının regülasyonunda önemli rol oynadığını gösterilmiştir.
PI3K)/AKT/mTOR sinyal yolağının düzensizliğine sebep olan mekanizmalardan biride vasküler endotelyal büyüme faktörü (VEGF) ve anjiyogenezi artıran HIF’lerin artan ekspresyonu ile tümörogenezi oluşturmaktadır.
mTORC1 and mTORC2 komplekslerinin aktivitesi HIF-1a ve HIF-2a’nın transkripsiyonundan sorumludur.18 Kanser hücrelerinde, hipoksi anjiyogenezin en güçlü uyarıcısıdır. Hipoksiye hücresel cevabı düzenleyen en önemli proteinler HIF’lerdir. HIFa ve HIFb subünitlerinden oluşur.
Hipoksik durumlar HIF’leri aktive eder, bu da anjiyogenez için gerekli çeşitli büyüme faktörlerinin ekspresyonunu uyarır. Bu faktörler arsında VEGF, temel fibroblast büyüme faktörü (bFGF) ve trombosit büyüme faktörü (PDGF) bulunmaktadır. Besin ve büyüme faktörleri bol miktarda bulunduğunda, mTOR aktive olur, bu da protein sentezi, hücre büyümesi ve hücre gelişimine neden olur.9 p53 geni DNA hasarı ve düşük besin seviyeleri gibi hücrede stresi indükleyen şartlar altında aktive edilen kritik bir tümör baskılayıcı proteini kodlamaktadır.
Bu proteinler sıklıkla malignitelerinde eksikliğe veya mutasyona uğramışlardır ve fonksiyonlarını kaybetmeleri kemoterapiye dirençle ilişkilidir. Yakın zamandaki bulgular mTOR sinyalinin p53 tarafından inhibe edildiğini ve p53’deki fonksiyon kaybının mTOR aktivasyonuyla sonuçlandığını göstermektedir.
mTOR protein ailesinin çok yönlü başka fonksiyonları da vardır. Aktin sito-iskelet, protein yıkımı, PKC sinyalizasyonu ve ribozom biyogenezinin organizasyonunda, hücre içi amino asit ve diğer esansiyel besin konsantrasyonlara yanıt olarak mRNA transkripsiyon ve protein translasyonun başlatılmasının düzenlenmesine katılırlar.
mTOR İNHİBİTÖRLERİ PI3K)/AKT/mTOR sinyal yolağının düzensizliği birçok kanser tipinin patogenezinde rol oynamaktadır. mTOR öncesi ve sonrası sinyal yolaklarının her ikisi de insan kanserlerinde yaygın olarak bozulmuştur. mTOR, PI3K/AKT’nin aşağı doğru akım yolağında fonksiyon gösteren anahtar bir kinaz olarak tanımlanmıştır ve bu yüzden onun inhibisyonu, potansiyel olarak önemli terapötik bir hedef olarak belirlenmiştir. En iyi bilinen mTOR inhibitörleri – rapamisin ve türevleri – klinik çalışmalarda uzun süreli objektif tümör yanıtı sağlamıştır.
Temsirolimus, ilerlemiş renal hücreli karsinom hastalarında sağ kalımı artırdığı gösterilmiş ilk mTOR inhibitör sınıfı ilaç olmuştur. Kötü prognozlu metastatik böbrek hücreli kanserin birinci basamak tedavisinde kullanılmaktadır. PI3K/AKT ekspresyonu ve aktivasyonun artması böbrek hücreli kanserde sık görülür. Başka bir mTOR inhibitörü olan everolimusun da metastatik böbrek hücreli kanser hasta grupunda progresyonsuz sağ kalımı uzattığı görülmüştür.
Everolimus; sunitinib veya sorafenib ile başarısız tedaviden sonra metastatik böbrek hücreli kanserinin tedavisinde oral olarak kullanılan bir ajandır. Temsirolimus ve everolimusun her ikisi de ilerlemiş nöroendokrin tümörlü hastalarda etkinliği kanıtlanmıştır.
Ridaforolimus, sarkomada etkinliği gösterilmiş bir mTOR inhibitörüdür.
mTOR inhibitörlerinin meme kanseri, lenfoma, mide kanseri ve akciğer kanserinde etkileriyle ilgili çalışmalar yapılmıştır. mTOR inhibitörlerinin tek ajan veya kombine tedavi olarak kullanımı, bir çok kanser tipinde 200 den fazla çalışmada test edilmiştir.
Moleküler biyolojinin daha da gelişmesi ile mTOR inhibitörleri ile kanser hücrelerinde bozulan yolakları hedef alan moleküler ilaçların geliştirilmesi kanser tedavisinde kolaylıklar sağlayacaktır.
Dicle Tıp Dergisi / Mehmet Küçüköner, Abdurrahman Işıkdoğan






